
Мы посвятили две статьи воздуху, без которого жизнь на нашей планете была бы невозможна. Теперь поговорим об углероде — элементе, который является основой жизни на земле. Ученые, уфологи и фантасты даже ввели в обиход термин «углеродная жизнь». И он вполне справедлив, так как все белки, аминокислоты, жиры, ДНК и РНК построены на основе углеводородных молекул.
планете была бы невозможна. Теперь поговорим об углероде — элементе, который является основой жизни на земле. Ученые, уфологи и фантасты даже ввели в обиход термин «углеродная жизнь». И он вполне справедлив, так как все белки, аминокислоты, жиры, ДНК и РНК построены на основе углеводородных молекул.
Углерод — простое неорганическое вещество, элемент таблицы Менделеева. Обозначается буквой «С» (Carboneum). В виде алмазов, графита и древесного угля известен человечеству с древнейших времен. Название carbone (углерод) впервые было введено в химическую науку французскими учеными. А. Лавуазье доказал, что уголь — это элементарное химическое вещество, а не носитель некоего невесомого флюида флогистона, отвечающего за горючие свойства веществ. Он же установил, что алмаз — это кристаллическая форма углерода.
Три формы углерода
Углерод — удивительное вещество, физические свойства которого и даже внешний вид описать однозначно просто невозможно. Этот элемент — рекордсмен по количеству аллотропных модификаций. Три формы углерода:
• кристаллическая: алмазы, наноалмазы, фуллерены, фуллерит, графиты, карбины, лонсдейлиты, углеродные нанотрубки и нановолокна, графен, волокна и структуры;
• аморфная: угли (древесный, в том числе активированный уголь, антрацит и др.), коксы, сажа, углеродная нанопена, стеклоуглерод, техуглерод;
• кластерная: астралены, диуглерод, углеродные наноконусы.
 Молекулы кристаллического углерода характеризуются правильной кристаллической решеткой. Большинство форм кристаллического углерода отличаются очень высокой твердостью и тугоплавкостью. Алмаз обладает высокой плотностью, почти не проводит тепло и ток. Графит, наоборот, имеет невысокую плотность и слоистое строение; проводит ток, может возгоняться, минуя жидкое состояние.
Молекулы кристаллического углерода характеризуются правильной кристаллической решеткой. Большинство форм кристаллического углерода отличаются очень высокой твердостью и тугоплавкостью. Алмаз обладает высокой плотностью, почти не проводит тепло и ток. Графит, наоборот, имеет невысокую плотность и слоистое строение; проводит ток, может возгоняться, минуя жидкое состояние.
Вещества, относящиеся к аморфным формам, не являются чистой формой углерода, но содержат углерод в очень значительных количествах. Для аморфного углерода характерна высокая теплоемкость, свойства полупроводников, невысокая плотность, относительно невысокая термостойкость — при температуре выше 1600 °С он превращается в графит. Как правило, их основой являются разные формы мелкокристаллического графита в виде неупорядочной структуры.
Углеродные кластеры — сложные соединения с очень интересными свойствами. Им, а также другим перспективным материалам на основе углерода, мы посвятим одну из ближайших статей.
Химические свойства
С химическими свойствами немного проще. В нормальных условиях углерод практически не вступает в реакции с другими элементами и веществами, инертен к кислотам, щелочам, галогенам. При высоких температурах проявляет сильные восстановительные свойства. Наиболее химически активны аморфные виды углерода, наиболее инертны — кристаллические. Графит по химической активности занимает серединное положение. При высоких температурах углерод окисляется кислородом (горит), образует несколько видов оксидов.
Графит и аморфный углерод при высоких температурах 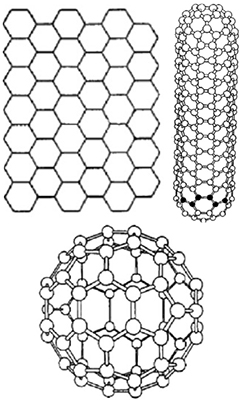 реагируют с водородом, азотом, фтором, галогенами, щелочными металлами, солями металлов, серой. В результате реакции с водородом и азотом получается синильная кислота. Взаимодействие большинства металлов, углерода, бора и кремния приводит к образованию карбидов. Углерод восстанавливает оксиды металлов до металлов. При определенных условиях удается преобразовать углерод, содержащийся в твердых видах топлива, в горючие газы (реакция газификации топлив очень важна для промышленности).
реагируют с водородом, азотом, фтором, галогенами, щелочными металлами, солями металлов, серой. В результате реакции с водородом и азотом получается синильная кислота. Взаимодействие большинства металлов, углерода, бора и кремния приводит к образованию карбидов. Углерод восстанавливает оксиды металлов до металлов. При определенных условиях удается преобразовать углерод, содержащийся в твердых видах топлива, в горючие газы (реакция газификации топлив очень важна для промышленности).
Главное свойство углерода — способность соединяться в длинные цепи, причем эти цепи могут содержать как атомы углерода, так и другие атомы. Цепи могут замыкаться, разветвляться, образовывать циклы, быть разной длины, соединяться («сшиваться») между собой в разнообразные структуры. Такие углеродно-водородные цепи — основа всей органической химии.
Следующая статья будет о содержании углерода в природе, его опасности и сферах применения.